Khoa học tự nhiên 8 (Kết nối tri thức với cuộc sống)
-
Chương I. Phản ứng hoá học
Bài 2. Phản ứng hoá học3 Topics|1 Quiz -
Bài 3. Mol và tỉ khối chất khí5 Topics|4 Quizzes
-
Bài 4. Dung dịch và nồng độ5 Topics|4 Quizzes
-
Bài 5. Định luật bảo toàn khối lượng và phương trình hoá học6 Topics|5 Quizzes
-
Bài 6. Tính theo phương trình hoá học4 Topics|4 Quizzes
-
Bài 7. Tốc độ phản ứng và chất xúc tác2 Topics|1 Quiz
-
Chương II. Một số hợp chất thông dụngBài 8. Acid2 Topics|1 Quiz
-
Bài 9. Base. Thang pH3 Topics|1 Quiz
-
Bài 10. Oxide3 Topics|1 Quiz
-
Bài 11. Muối3 Topics|1 Quiz
-
Bài 12. Phân bón hoá học2 Topics|1 Quiz
-
Chương III. Khối lượng riêng và áp suấtBài 13. Khối lượng riêng1 Topic
-
Bài 14. Thực hành xác định khối lượng riêng1 Topic
-
Bài 15. Áp suất trên một bề mặt1 Topic
-
Bài 16. Áp suất chất lỏng. Áp suất khí quyển2 Topics
-
Bài 17. Lực đẩy Archimedes1 Topic
-
Chương IV. Tác dụng làm quay của lựcBài 18. Tác dụng làm quay của lực. Moment lực2 Topics
-
Bài 19. Đòn bẩy và ứng dụng2 Topics
1. ĐỊNH NGHĨA
– Phương trình hóa học là phương trình biểu diễn ngắn ngọn phản ứng hóa học.
Ví dụ: Phương trình chữ của phản ứng hóa học giữa khí hiđro và khí oxi tạo ra nước là:
Khí hiđro + khí oxi → nước
– Thay tên các chất bằng công thức hóa học được sơ đồ của phản ứng:
H2 + O2 —> H2O
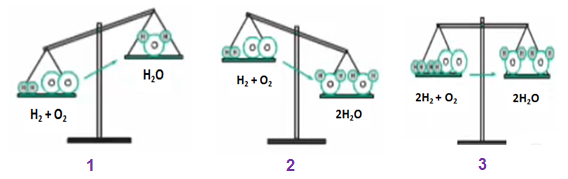
– Ở hình 1: Nếu theo sơ đồ phản ứng: H2 + O2 —> H2O thì
+ Vế trái có 2 nguyên tử H và 2 nguyên tử O
+ Vế phải có 2 nguyên tử H và 1 nguyên tử O
=> vế trái có khối lượng lớn hơn vì hơn 1 nguyên tử O
– Ở hình 2: Nếu vế trái nhiều hơn 1 nguyên tử O thì ta thêm hệ số 2 trước vế phải, lúc này:
+ Vế trái: 2 nguyên tử H và 2 nguyên tử O
+ Vế phải: 4 nguyên tử H và 2 nguyên tử O
=> vế phải có khối lượng lớn hơn, do hơn 2 nguyên tử H
– Ở hình 3: ta thêm hệ số 2 vào trước H2 và H2O
+ Vế trái: 4 nguyên tử H và 2 nguyên tử O
+ Vế phải: 4 nguyên tử H và 2 nguyên tử O
=> khối lượng của 2 vế bằng nhau, số nguyên tử của mỗi nguyên tố đã bằng nhau
Phương trình hóa học của phản ứng viết như sau: 2{{H}_{2}}+{{O}_{2}}\to 2{{H}_{2}}O
2. CÁC BƯỚC LẬP PHƯƠNG TRÌNH HÓA HỌC
Bước 1: Viết sơ đồ phản ứng, gồm công thức hóa học của chất tham gia, sản phẩm.
Bước 2: Cân bằng số nguyên tử mỗi nguyên tố: tìm hệ số thích hợp đặt trước các công thức sao cho số nguyên tử các nguyên tố ở chất tham gia và chất tạo thành là bằng nhau.
Bước 3: Viết thành phương trình hóa học.
Chú ý:
– Không được thay đổi các chỉ số trong công thức hóa học đã viết đúng. Ví dụ như 3O2 (đúng) chuyển thành 6O (sai)
– Viết hệ số cao bằng kí hiệu hóa học. Ví dụ: 2Al, 3Fe (đúng), không viết là 2Al, 3Fe
– Trong các công thức hóa học có các nhóm nguyên tử như OH, SO4,… thì coi cả nhóm như 1 đơn vị để cân bằng, trước và sau phản ứng số nhóm nguyên tử phải bằng nhau.
Ví dụ: Lập phương trình hóa học cho phản ứng hóa học sau: photpho + oxi → điphotpho pentaoxit (P2O5)
Hướng dẫn:
Bước 1: Sơ đồ của phản ứng: P + O2 —> P2O5
Bước 2: Đặt hệ số thích hợp trước từng công thức. Ta thấy số nguyên tử P và O đều không bằng nhau, nhưng nguyên tố oxi có số nguyên tử nhiều hơn. Ta bắt đầu từ nguyên tố này. Trước hết làm chẵn số nguyên tử O ở bên phải, đặt hệ số 2 trước P2O5 ta được:
P + O2 —> 2P2O5
Bên trái cần có 4P và 10O hay 5O2, các hệ số 4 và 5 là thích hợp
Bước 3: Viết phương trình hóa học: 4P + 5O2 → 2P2O5
Điền hệ số nguyên, tối giản vào trước các chất trong sơ đồ để hoàn thành những phương trình hoá học sau:
a) __ Fe + __ O2 → __Fe3O4
b) __ Al + __ HCl → __ AlCl3 + __ H2
c) __ Al2(SO4)3 + __ NaOH → __ Al(OH)3 + __ Na2SO4
a) 3Fe + 2O2 → 1Fe3O4
(Lưu ý khi viết phương trình phản ứng, với những hợp chất có hệ số 1 thì không cần điền hệ số)
b) 2Al + 6HCl → 2AlCl3 + 3H2
c) Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
2. Ý nghĩa của phương trình hoá học
– Phương trình hoá học cho biết trong phản ứng hoá học, lượng các chất tham gia phản ứng và các chất sản phẩm tuân theo một tỉ lệ xác định.
Ví dụ 1: Xét phương trình hoá học: 4Al + 3O2 → 2Al2O3
Cứ 4 nguyên tử Al phản ứng với 3 phân tử O2 tạo ra 2 phân tử Al2O3.
Số nguyên tử Al : Số phân tử O2 : Số phân tử Al2O3 = 4 : 3 : 2
Số mol Al : Số mol O2 : Số mol Al2O3 = 4 : 3 : 2
Từ tỉ lệ số mol, ta xác định được tỉ lệ về khối lượng các chất:
Khối lượng Al : Khối lượng O2 : Khối lượng Al2O3 = (27 x 4) : (32 x 3) : (102 x 2) = 9 : 8 : 17.
Nghĩa là cứ 9 gam Al phản ứng hết với 8 gam O2 tạo ra 17 gam Al2O3.
Giả thiết trong không khí, sắt tác dụng với oxygen tạo thành gỉ sắt (Fe2O3). Từ 5,6 gam sắt có thể tạo thành tối đa bao nhiêu gam gỉ sắt?
Số mol của sắt là: n_{Fe}=\dfrac{5,6}{56}=0.1\text{ (mol)}
Sơ đồ phản ứng:
Sắt + Oxygen → Iron (III) oxide
Phương trình hoá học của phản ứng trên
4Fe + 3O2 → 2Fe2O3
Vậy cứ 4 mol Fe phản ứng sẽ tạo thành 2 mol Fe2O3.
→ 0,1 mol Fe phản ứng sẽ tạo thành 0,05 mol Fe2O3.
→ Khối lượng gỉ sắt là: m_{Fe_{2}O_{3}}=0,05×(56×2+16×3)=8\text{ gam}

